Руководство
TPS стремится помочь в организации соблюдения требований к надлежащему производству лекарственных средств, путем внедрения системы качества и предоставления плана.
TPS стремится помочь в организации соблюдения требований к надлежащему производству лекарственных средств, путем внедрения системы качества и предоставления плана.

В течение последних десятилетий было отмечено, что клиенты становятся все более и более осведомленными о качестве. Одной из возможных причин может быть то, что люди хотят достичь совершенства. Фармацевтические отрасли промышленности сталкиваются с жесткой конкуренцией между собой, и для выживания в этой среде, одной из важных проблем, которую необходимо рассмотреть, является создание и внедрение соответствующей и эффективной системы качества, которая помогает предоставлять, более безопасные, более эффективные и качественные фармацевтические препараты.
Менеджмент качества в фармацевтической промышленности является важной темой, потому что лекарства / или фармацевтические продукты напрямую доставляются в организм потребителя, таким образом, подлинность, чистота, безопасность и, в конечном счете, надлежащее качество продукта являются крайне необходимыми [3].
В мире существует множество руководств, в которых сформулированы спецификации, которым должна соответствовать каждая фармацевтическая промышленность.

Риск для его качества является лишь одним из компонентов общего риска.

Лекарства низкого качества являются не только опасностью для здоровья, но и пустой тратой денег как для государственных заказчиков, так и для отдельных потребителей, поскольку они могут содержать токсичные вещества, которые были непреднамеренно добавлены. Например, на Гаити в 1996 году более 80 детей умерло после получения сиропа от кашля и простудных заболеваний, содержащего глицерин, загрязненный диэтиленгликолем (1).

Нарушенные правила FDA, FDA уведомляет производителя. Обычно, это уведомление в форме
Предупредительного письма, в том числе опубликованного в открытом доступе, чтобы информировать других производителей о потенциальных недоработках.

Администрация США по контролю за продуктами и лекарствами (FDA) проверила фирму по производству лекарств Indoco Remedies Limited и отправила предупредительное письмо 16 июля 2019 г. Одной из проблем этой компании было то, что они не устраняли несоответствия наблюдаемые в производстве их продукта, кроме того информация о документах производства и контроле качества была недостаточной.
Чтобы показать важность обработки CAPA, в этой статье TPS хочет привести пример одного из предупредительных писем, отправленных канадской фармацевтической компании в последнем месяце 2019 года.
В течение последних десятилетий было отмечено, что клиенты становятся все более и более осведомленными о качестве. Одной из возможных причин может быть то, что люди хотят достичь совершенства. Фармацевтические отрасли промышленности сталкиваются с жесткой конкуренцией между собой, и для выживания в этой среде, одной из важных проблем, которую необходимо рассмотреть, является создание и внедрение соответствующей и эффективной системы качества, которая помогает предоставлять, более безопасные, более эффективные и качественные фармацевтические препараты.
В связи с этим органы надзора по всему миру внедрили различные строгие и обязательные руководящие принципы для обеспечения производства фармацевтической продукции с гарантированным качеством.
Несмотря на производственную практику, эти подходы и руководящие принципы не ясны, особенно для начинающих.
В этой статье мы представляем всесторонний обзор Фармацевтической системы качества (PQS), предложенной ICHQ10 и определенной в различных руководствах, в которых области охвата шире, чем у GMP, и включают в себя также фармацевтическую разработку.
Концепция действующей системы менеджмента качества фармацевтической продукции основана на согласованном на международном уровне руководстве ICH Q10, в котором описывается модель системы качества фармацевтической продукции, которая поощряет использование научно-обоснованных подходов и основывается на рисках, и может быть реализована на всех этапах жизненного цикла продукта. Он служит эффективной системой управления качеством для фармацевтической промышленности [5].
ICH Q10 описывает, что PQS – это система управления, которая направляет и контролирует фармацевтическую компанию в отношении качества.
Проект, организация и документация фармацевтической системы качества должны быть хорошо структурированы и понятны, чтобы облегчить общее понимание и последовательное применение.
Система качества фармацевтической продукции должна включать в себя соответствующие процессы, ресурсы и обязанности для обеспечения гарантии качества аутсорсинговой деятельности и закупаемых материалов [1].
В «pics pe 009-14 part i» было упомянуто и отмечено, что владелец разрешения на производство должен производить лекарственные средства, чтобы гарантировать, что они соответствуют своему назначению, соответствуют требованиям разрешения на продажу или разрешения на проведение клинических испытаний, в зависимости от обстоятельств, и не подвергает пациентов риску из-за недостаточной безопасности, качества или эффективности.
Для надежного достижения этой цели в области качества должна существовать всесторонне разработанная и правильно внедренная система качества фармацевтической продукции, включающая надлежащую производственную практику и управление рисками качества [2].
Для кого предназначена фармацевтическая система качества – это широкое понятие, охватывающее все вопросы, которые индивидуально или коллективно влияют на качество продукта. В рамках организации обеспечение качества служит инструментом управления [3].
В руководстве агентства министерства здравоохранения и социальных служб США (FDA) уточняется, что: каждый фармацевтический препарат имеет установленную подлинность, дозировку, чистоту и другие качественные характеристики, предназначенные для обеспечения необходимого уровня безопасности и эффективности.
Главной целью системы качества является создание устойчивого производства безопасной и эффективной продукции и гарантированное обеспечение поддержания такого производства. Профессионалы в области качества знают, что одни только благие намерения не обеспечат хороших результатов [4].
Соблюдение всех элементов фармацевтической системы качества, требует обеспечения
квалифицированным персоналом, необходимыми помещениями, оборудованием и техническими средствами. Основные принципы управления качеством, надлежащей практики и управления рисками для качества взаимосвязаны. Фармацевтическая система качества должна гарантировать, что:
1-выпуск продукции обеспечивается посредством разработки, планирования, внедрения, поддержания и непрерывного усовершенствования системы, которая дает возможность постоянно поставлять продукцию с соответствующими показателями качества;
2-лекарственные средства разрабатываются и совершенствуются таким образом, чтобы учитывать требования надлежащей производственной практики [2].

Эта диаграмма иллюстрирует основные особенности модели фармацевтической системы качества ICH Q10 (PQS). PQS охватывает весь жизненный цикл продукта, включая фармацевтическую разработку, перенос технологий, промышленное производство и прекращение производства продукции, как показано в верхней части диаграммы. PQS дополняет региональные требования к GMP, как показано на диаграмме. Диаграмма также иллюстрирует, что региональные GMP применяются к производству исследуемых препаратов. В следующей горизонтальной строке показана важность обязанностей по контролю на всех этапах жизненного цикла продукта, указанных в разделе 2.
В следующей горизонтальной строке перечисляются элементы PQS, которые являются основополагающими в данной системе.
Эти элементы должны быть применены пропорционально на каждом этапе жизненного цикла, для определения областей требующих непрерывного улучшения.
Нижняя группа горизонтальных строк иллюстрирует инструменты реализации: менеджмент знаний и управление рисками качества, которые должны быть применены на протяжении этапов жизненного цикла. Эти инструменты реализации поддерживают цели PQS в достижении реализации продукта, установлении и поддержании контроля и содействии непрерывному улучшению. [1].
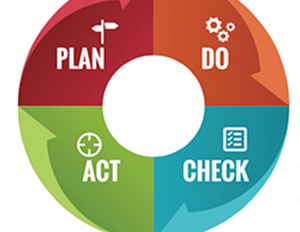
Непрерывного улучшения фармацевтической системы качества можно достигнуть следующим образом:
• контроль со стороны руководства в области фармацевтической системы качества
• мониторинг внутренних и внешних факторов, влияющих на фармацевтическую систему качества
• результаты контроля со стороны руководства и мониторинга; [1]
необходимо уточнить, что внедрение эффективной системы качества в производственной организации требует значительных инвестиций времени и ресурсов [4].
Однако, FDA считает, что долгосрочные выгоды от реализации системы качества будут превосходить затраты.
В соответствии с руководством FDA, при правильной его реализации, надежная модель качества, может обеспечить контроль за последовательным производством продукта приемлемого качества.
Данная модель должна быть описана в соответствии с четырьмя основными факторами:
Надежная система качества будет способствовать согласованности процессов путем интеграции эффективных механизмов формирования знаний в повседневные операционные решения.
Как надлежащая производственная практика, так и деловая практика требуют надежной системы качества. При полной разработке и эффективном управлении система качества приведет к стабильным, прогнозируемым процессам, обеспечивающим безопасность, эффективность и доступность фармацевтических препаратов для потребителя [4].
Ссылки :
Менеджмент качества в фармацевтической промышленности является важной темой, потому что лекарства / или фармацевтические продукты напрямую доставляются в организм потребителя, таким образом, подлинность, чистота, безопасность и, в конечном счете, надлежащее качество продукта являются крайне необходимыми [3].
В мире существует множество руководств, в которых сформулированы спецификации, которым должна соответствовать каждая фармацевтическая промышленность.
Для поддержания качества фармацевтической продукции используется система менеджмента качества.
Система менеджмента качества (СМК) — это совокупность бизнес-процессов, ориентированных на достижение желаемого качества, путем установления регуляторной политики и требований к качеству необходимых заказчику.
Принятие СМК должно быть стратегическим решением организации.
На разработку и внедрение системы менеджмента качества организации влияют изменяющиеся потребности, конкретные цели, выпускаемая продукция, применяемые процессы, а также размер и структура организации.
«Управление качеством в фармацевтической промышленности: философия и основные элементы» описывает общие концепции обеспечения качества, а также основные компоненты или подсистемы GMP, которые являются совместной ответственностью высшего руководства, а так же управления производством и контролем качества.
К ним относятся гигиена, валидация, самоинспекция, персонал, помещения, оборудование, материалы и документация. В фармацевтической промышленности в целом, управление качеством обычно определяется как аспект функции управления, который определяет и реализует «политику качества», то есть общее намерение и направление организации в отношении качества, как это официально выражено и утверждено высшим руководством. Основными элементами управления качеством являются:
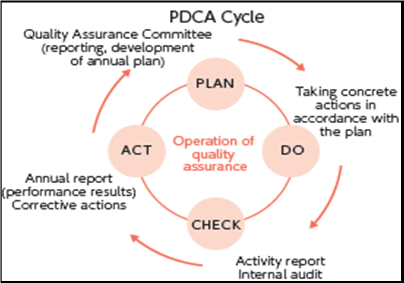
Система менеджмента качества обычно состоит из четырех аспектов:
А) планирование качества:Процесс преобразования политики качества в процессы, процедуры и инструкции для достижения измеримых целей и требований.
B) обеспечение качества: запланированные и методические действия, выполняемые как часть системы качества, для обеспечения уверенности в том, что требования к качеству процесса, продукта или услуги удовлетворяются.
C) контроль качества: действия по мониторингу, оценке и корректировке процесса, продукта или услуги для обеспечения соответствия требованиям качества.
D) улучшение качества: процесс анализа производительности и принятия методических, системных действий для ее улучшения [3]
Понимание и внедрение соответствующей модели системы менеджмента качества, позволяет фармацевтической организации выполнять свои этические и нормативные обязанности, включая контроль подлинности, управление качеством, безопасностью, чистотой и эффективностью готового лекарственного средства. Это также оправдано с точки зрения ведения бизнеса. [4].
REFERENCES:
Производство и использование лекарственного продукта (включая его компоненты) обязательно сопряжено с определенной степенью риска.
Риск для его качества является лишь одним из компонентов общего риска.
Важно понимать, что высокое качество продукта должно поддерживаться на протяжении всего его жизненного цикла, чтобы свойства, важные для качества лекарственного препарата, оставались такими же, как те, которые наблюдались во время клинических исследований.
Эффективный подход к управлению рисками по качеству может дополнительно обеспечить высокое качество лекарственного препарата для потенциального пациента, предоставляя профилактические средства для выявления и контроля потенциальных проблем с качеством во время разработки и производства.
Кроме того, использование управления рисками качества может улучшить принятие решений, при возникновении проблем с качеством. Эффективное управление рисками качества может способствовать принятию лучших и более обоснованных решений, также может обеспечить регулирующим органам большую уверенность в способности компании справляться с потенциальными рисками и может благотворно повлиять на степень и уровень прямого надзора со стороны регулирующих органов.
Надлежащее использование управления рисками качества может облегчить, но не снимает обязательства перед отраслью, соблюдать нормативные требования и не заменяет соответствующее взаимодействие между отраслью и регулирующими органами.
Два основных принципа управления рисками качества:
Управление рисками качества
Управление рисками качества — это систематический процесс оценки, контроля, передачи и анализа рисков для качества лекарственного препарата в течение всего его жизненного цикла.
Модель управления рисками качества представлена на диаграмме. Можно использовать другие модели.
От случая к случаю, внимание к отдельным компонентам структуры может отличаться, но надежный процесс будет включать детальное рассмотрение всех элементов, соразмерно с конкретным риском. Обзор типичного процесса управления рисками качества представлен на фото ниже:

Ответственность
Деятельность по управлению рисками качества обычно, но не всегда, осуществляется многопрофильными группами.
Когда группы сформированы , они должны включать экспертов из соответствующих областей (например, подразделения по качеству, по развитию бизнеса, по вопросам регулирования, инжиниринга, производственной деятельности, продажам и маркетингу, юриспруденции, статистике и медицинским вопросам) в дополнение к лицам, которые осведомлены о процессе управления рисками качества.
Начало процесса управления рисками качества
Управление рисками качества должно включать систематические процессы, предназначенные для координации, упрощения и совершенствования научно обоснованных решений в отношении риска. Возможные шаги, используемые для инициирования и планирования процесса управления рисками качества, могут включать следующее:
– определить проблему и / или вопрос о риске, включая соответствующие предположения, определяющие потенциал риска
– собрать исходную информацию и / или данные о потенциальной опасности, вреде или воздействии на здоровье человека, имеющие отношение к оценке риска
– определить ответственного руководителя и необходимые ресурсы
– указать сроки, результаты и соответствующий уровень принятия решений для процесса управления рисками
Оценка степени риска
Оценка риска состоит из идентификации опасностей, анализа и оценки рисков, связанных с воздействием этих опасностей (как определено ниже).
Оценка риска качества начинается с четко определенного описания проблемы или вопроса о риске.
Когда рассматриваемый риск четко определен, будет легче подобрать соответствующий инструмент управления рисками и получить необходимую информацию для решения проблемы.
Существует три фундаментальных вопроса, которые помогут четко определить и оценить уровень риска (ов):
Идентификация риска
Идентификация риска — это систематическое использование специализированной информации для выявления опасностей, относящихся к вопросу риска или описанию проблемы.
Анализ риска
Анализ риска — это определение риска, связанного с выявленными опасностями.
Оценка риска
Оценка риска сравнивает выявленный и проанализированный риск с предоставленными критериями риска.
Оценка риска учитывает силу доказательств по всем трем основным вопросам.
Результатом оценки риска является либо количественная оценка риска, либо качественное описание диапазона риска. Когда риск выражается количественно, используется числовая вероятность. Так же, риск может быть выражен с использованием качественных идентификаторов, таких как «высокий», «средний» или «низкий», которые должны быть определены как можно более подробно.
Контроль риска:
Контроль рисков включает в себя принятие решений по снижению и / или принятию рисков. Целью контроля риска является снижение риска до приемлемого уровня.
Снижение риска:
Снижение риска фокусируется на процессах снижения или предотвращения риска для качества, когда он превышает определенный (приемлемый) уровень (см. Рис. 1). Снижение риска может включать действия, предпринятые для уменьшения серьезности и вероятности причинения вреда.
Принятие риска:
Принятие риска — это решение принять риск. Принятие риска может быть формальным решением о принятии остаточного риска или пассивным решением, в котором остаточные риски не уточняются.
Коммуникация риска:
Коммуникация риска — это обмен информацией о риске или совместное использование этой информации между лицом, принимающим решение и другими причастными сторонами.
Анализ рисков:
Управление рисками должно быть неотъемлемой частью процесса управления качеством.
Должен быть реализован механизм анализа или мониторинга событий.
Результаты процесса управления рисками следует пересматривать, чтобы учесть новые знания и опыт.
После начала процесса управления рисками качества этот процесс следует продолжать использовать вплоть до тех событий, которые могут повлиять на первоначальное решение по управлению рисками для качества, независимо от того, планируются ли эти события (например, результаты анализа продукта, инспекции, аудит, управление изменениями) или незапланированные (Например, первопричина от неудачных расследований, отзыв продукции).
Частота анализа рисков должна основываться на уровне риска.
Анализ риска может включать пересмотр решений о принятии риска.
Кроме того, фармацевтическая промышленность и регулирующие органы могут оценивать риск и управлять им, используя признанные средства управления рисками и / или внутренние процедуры (например, стандартные операционные процедуры(SOP)).
Ниже приведен неполный список некоторых из этих средств:
Управление рисками качества должно быть направлено на повышение уровня защиты пациента путем снижения риска, которому этот пациент подвергается во время получения лекарственного препарата [3].
Была проделана большая работа по улучшению качества лекарственных средств, которые в настоящее время включены в нормативную базу.
Тем не менее, есть много вопросов в этой области, которые требуют внимания. QRM помогает в управлении рисками для пациентов и для компаний.
Различные производственные проблемы все еще возникают в более поздний период или во время выпуска партии, что приводит к сложным и дорогостоящим исследованиям и другим серьезным дефектам качества и, в конечном итоге, приводит к отзыву продукта и приостановке партии.
Реальная выгода от применения QRM в производстве лекарств заключается в получении более безопасных лекарств для пациентов. Это также позволяет выполнять экономически выгодные и эффективные подходы к квалификации, валидации, управлению изменениями и другим областям контроля качества [4].
REFERENCES:
Лекарства низкого качества являются не только опасностью для здоровья, но и пустой тратой денег как для государственных заказчиков, так и для отдельных потребителей, поскольку они могут содержать токсичные вещества, которые были непреднамеренно добавлены. Например, на Гаити в 1996 году более 80 детей умерло после получения сиропа от кашля и простудных заболеваний, содержащего глицерин, загрязненный диэтиленгликолем (1). Если бы производитель следовал надлежащей производственной практике (GMP), эти смерти можно было бы предотвратить. Кроме того, лекарство, которое содержит мало или не содержит заявленного активного ингредиента, не будет иметь предполагаемого терапевтического эффекта. Антибиотик с некоторым, но недостаточным количеством активного вещества не излечит от инфекции. Хуже того, бактерии, подвергающиеся воздействию низких уровней антибиотика, не будут уничтожены, а напротив, могут стать устойчивыми к лекарству даже при правильной дозировке, что подвергает риску больше жизней [1].
Кто определяет надлежащую производственную практику (GMP) как «ту часть обеспечения качества, которая гарантирует, что продукты постоянно производятся и подвергаются контролю в соответствии со стандартами качества, соответствующими их предполагаемому использованию и в соответствии с требованиями разрешения на продажу»? GMP охватывает все аспекты производственного процесса: установленный производственный процесс; утвержденные критические этапы производства; соответствующие помещения, склад, транспорт; квалифицированный и обученный персонал производства и контроля качества; адекватное лабораторное оборудование; утвержденные письменные процедуры и инструкции; записи, чтобы показать все шаги определенных проведенных процедур; Полная прослеживаемость продукта посредством досье на производство и дистрибуцию; и системы для отзывов и рассмотрения жалоб. Руководящий принцип GMP заключается в том, что качество встроено в продукт, а не просто проверяется в готовом продукте. Таким образом, гарантия заключается в том, что продукт не только соответствует окончательным спецификациям, но и что он каждый раз был изготовлен с использованием одних и тех же процедур в одних и тех же условиях. Есть много способов осуществления подобного контроля — контроль качества установки и ее систем, контроль качества исходных материалов, контроль качества производства на всех этапах, контроль качества тестирования продукта, контроль подлинности материалов путем надлежащей маркировки и разделения, контроль качества материалов и продукции путем надлежащего хранения и т. д. Все эти элементы управления должны следовать строгим предписаниям и утвержденным процедурам, написанным в виде протоколов, SOPS или основных формул, описывающих все задачи, выполняемые в ходе всего процесса производства и контроля [2].
GMP предотвращает ошибки, которые невозможно устранить с помощью контроля качества готовой продукции.
Без GMP невозможно быть уверенным в том, что каждая единица лекарственного средства имеет то же качество, что и испытанные в лаборатории. В начале 1970-х годов производитель в Соединенном Королевстве произвел инфузионную жидкость, которая стала причиной смерти пяти пациентов, поскольку она была сильно загрязнена бактериями (3). Перед распределением жидкости производитель проверил несколько бутылок и обнаружил, что они стерильны. В конечном итоге в стерилизаторе была обнаружена техническая неисправность: бутылки в нижней части не были должным образом стерилизованы. Бутылки, которые тестировал производитель, были из верхней части, создавая ложное впечатление, что все бутылки были стерильными [1].
Соблюдение норм GMP является необходимым условием для получения разрешения на маркетинг, иными словами, отечественные и зарубежные производители фармацевтических компаний не могут продавать свои лекарства без него в зарубежных странах. В то время как соответствие нормам GMP не было общепринятым в развитых странах, правительства менее развитых стран вынуждены соблюдать требования GMP при выдаче разрешений на маркетинг местным компаниям, а другие компании разработали различные стратегии для обеспечения того, чтобы развивающиеся страны приняли правила. Соблюдение норм GMP требуют крупных инвестиций в модернизацию производственных мощностей, что особенно актуально для местных производителей.
Любопытным эмпирическим вопросом является влияние этих изменений на местные рынки, а также на доступность лекарств в развивающихся странах. [3]
Чтобы достичь и поддерживать соответствие нормам GMP, каждый менеджер и руководитель должен постоянно помнить сам и напоминать другим об основных и самых значимых нормах GMP, обучать и развивать всех сотрудников, а также участвовать во всех проводимых официальных программах обучения. Высшее руководство должно публично заявить и показать своими действиями, что соблюдение GMP – единственный способ, которым их компания ведет бизнес. Если вы хотите, чтобы люди постоянно следили за соблюдением GMP, они должны знать, как и зачем появились эти правила. Большинство требований было введено как реакция на трагические обстоятельства и для предотвращения будущих трагедий [4].
References:
Как вы вероятно знаете, когда FDA обнаруживает, что производитель имеет значительные
Нарушенные правила FDA, FDA уведомляет производителя. Обычно, это уведомление в форме
Предупредительного письма, в том числе опубликованного в открытом доступе, чтобы информировать других производителей о потенциальных недоработках. Компания TPS предоставляет своим клиентам краткое содержание этих писем, чтобы поделиться полезной и поучительной информацией, получить полезные рекомендации и извлечь определенные уроки.
Администрация США по контролю за продуктами и лекарствами (FDA) проверила фирму по производству лекарств Indoco Remedies Limited и отправила предупредительное письмо 16 июля 2019 г. Одной из проблем этой компании было то, что они не устраняли несоответствия наблюдаемые в производстве их продукта, кроме того информация о документах производства и контроле качества была недостаточной. Некоторые пункты из текста письма, кратко изложены ниже:
CAPA играет важную роль в системе управления рисками. Методика CAPA должна привести к улучшению и лучшему пониманию продукта и процесса производства. CAPA отвечает за сбор, анализ, определение и расследование проблем с качеством и продукцией, а также за принятие эффективных и надлежащих профилактических и / или корректирующих действий в попытке предотвратить их возникновение или повторное возникновение. Чтобы показать важность обработки CAPA, в этой статье TPS хочет привести пример одного из предупредительных писем, отправленных канадской фармацевтической компании в последнем месяце 2019 года.
Предупредительное письмо 320-20-15 от 23 декабря 2019 года:
Аудит проведенный FDA в сентябре 2019 года выявил, что в то время компания не проводила регулярную калибровку, осмотр или проверку в соответствии с инструкцией установленной в письменной форме и предназначенной для обеспечения надлежащей производительности и ведения соответствующего документального оформления проверок калибровки и проверок автоматического, механического, электронного и других видов оборудования, включая компьютеры, используемые при производстве, обработке, упаковке и хранении лекарственного препарата (21 CFR 211.68(a)).
В дальнейшем, данная фармацевтическая компания предоставила CAPA, но FDA не вступила с ними в дальнейшую переписку, скорее всего из-за предоставления недостаточно подробной информации или отсутствия доказательств корректирующих действий, чтобы привести свою деятельность в соответствие с cGMP.
Вот один из примеров допущенных ошибок в действиях компании:
Компания заявила, что они будут случайным образом выбирать досье на серию для сравнения с данными HMI и будут расследовать любые расхождения между ними. FDA пояснила, что не считает такие действия удовлетворительными, так как они не будут брать на себя обязательство полностью оценить масштабы расхождений между данными HMI и досье на серию или действия операторов, не выполняющих инструкции. Кажется, что компания не установила причину этих несоответствий. Кроме того, они не расширили область расследования, включив в него возможные расхождения в записях в других областях деятельности, и не предоставили оценку уже выпущенной продукции. Компания так же не исправляла должным образом ошибки в управлении производством и службы обеспечения качества документации и целостностью данных (QU).